Peste Porcina Africana (PPA)
Investigación / Protocolos / Vídeos
Tesis Doctorales / Publicaciones indexadas / Publicaciones de divulgación
La Peste Porcina Africana (PPA) representa actualmente el mayor desafío para el sector porcino a nivel global y el mayor problema actual de la sanidad animal. Es una enfermedad infecciosa causada por el virus de la PPA que afecta a suidos, tanto domésticos como silvestres. Por sus importantes implicaciones económicas y sanitarias se encuentra en la lista de enfermedades de declaración obligatoria de la Organización Mundial de Sanidad Animal (OIE).
Su situación actual es de enorme preocupación a nivel mundial debido a su extensa expansión durante los últimos años, afectando en la actualidad acuatro continentes donde habitan más del 78% de la población porcina mundial. La PPA no sólo se ha mantenido en numerosos países africanos, también ha ido avanzando por países del continente europeo y ha afectado, por primera vez, al continente asiático e islas cercanas a Australia. En Asia se ha abierto paso a través del mayor productor porcino, China, que alberga cerca de la mitad de la población porcina mundial. Durante el año 2019, el número de cerdos domésticos sacrificados debido a la PPA fue diez veces mayor que en el 2007 y cinco veces mayor que en el 2018 (Tabla 1).
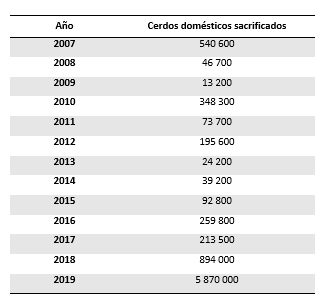 Tabla 1. Número total de cerdos domésticos sacrificados al año por causa de la peste porcina africana (Fuente: OIE y FAO).
Tabla 1. Número total de cerdos domésticos sacrificados al año por causa de la peste porcina africana (Fuente: OIE y FAO).
Una de las razones de su gran expansión sin control es la falta de vacunas y tratamientos disponibles para luchar contra ella, lo que nos deja obligados a tomar medidas sanitarias estrictas. Sin embargo, en ciertas circunstancias, implementar las medidas de bioseguridad necesarias para frenar su difusión implica cambios de prácticas tradicionales y costumbres ancestrales, lo que representa un verdadero reto para los sanitarios.
En esta sección encontrará toda la información de la epidemiología de la enfermedad, sus antecedentes, la situación actual y los nuevos retos de investigación de la misma, así como actualizaciones periódicas mediante el envío de nuevas comunicaciones.
Antecedentes de la PPA
La PPA fue descrita por primera vez en Kenia en 1921, por Montgomery. Se describió como una enfermedad con alto nivel de letalidad (99%) en los cerdos europeos recién importados. En las siguientes décadas, se observó su presencia en varios países de África subsahariana.
La primera vez que la PPA se reportó fuera del continente africano fue en Portugal en 1957, en una granja de cerdos domésticos cercana a Lisboa. No obstante, este foco fue rápidamente controlado tras el sacrificio de más de 10 000 cerdos domésticos. Tras un silencio epidemiológico de tres años, en 1960 volvió a manifestarse la enfermedad en el país vecino, desde donde se extendió por toda la Península Ibérica. La PPA permaneció en la Península Ibérica de forma endémica durante aproximadamente 35 años, hasta que en 1995 se logró la erradicación de la misma, tras grandes esfuerzos y costes económicos.
Durante estos años de presencia de PPA en la Península Ibérica, varios países europeos y americanos sufrieron brotes de PPA en sus fronteras (Figura 1), originados principalmente por movimientos de productos cárnicos contaminados. No obstante, todos estos focos fueron erradicados, a excepción de la isla de Cerdeña, donde la enfermedad ha estado presente por más de 40 años, desde 1978. Actualmente, la isla de Cerdeña lleva más de un año sin notificaciones positivas en domestico ni jabalíes. Su solicitud de declaración como país libre de PPA está en marcha.
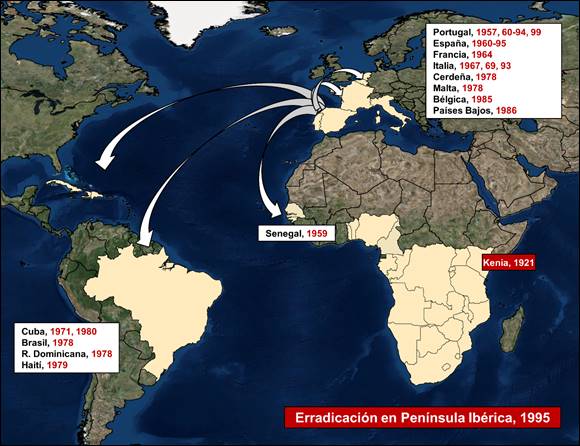
Figura 1. Epidemiología de la PPA desde 1957 hasta 1999.
Desde la erradicación de la PPA en España en 1995, a excepción de la isla de Cerdeña y un brote aislado en 1999 en Portugal, la enfermedad permaneció confinada en el continente africano. En las última décadas, la PPA ha adquirido gran importancia en África, afectando a un gran número de países anteriormente libres de la enfermedad, extendiéndose por el Oeste y Centro del continente, con el consiguiente aumento de virus circulante y, por lo tanto, de productos cárnicos contaminados.
Este hecho pudo contribuir al salto epidemiológico en el año 2007, con la reentrada del virus de la PPA en el continente europeo, a partir de la región Caucásica, concretamente en el puerto de Poti en Georgia. Desde entonces, la PPA se ha ido difundiendo sin control hacia nuevos territorios.
Situación actual de la Peste Porcina Africana
Actualmente, la PPA se encuentra presente en cuatro continentes (África, Europa, Asia y Oceanía), superando cualquier escenario histórico, donde se observan distintos patrones epidemiológicos (Figura 2). El estudio de los diferentes patrones epidemiológicos es esencial para un enfoque eficaz del diseño y la implementación de las medidas de prevención y control. A continuación, se detallan los distintos escenarios epidemiológicos observados en la actualidad.
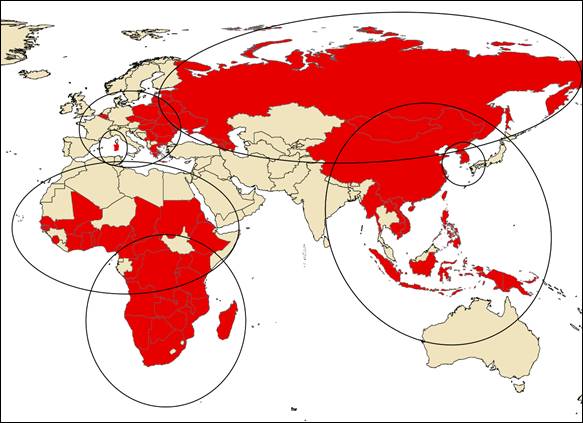
Figura 2. Escenarios epidemiológicos actuales de la peste porcina africana.
Mapa
Notificaciones de la peste porcina Africana a la OIE

Peste Porcina Africana en África
En África, la población porcina se ha duplicado durante las últimas tres décadas, lo que ha dado lugar a un incremento en el número de notificaciones y regiones afectadas por PPA. Actualmente, gran parte de los países subsaharianos están afectados por esta enfermedad de forma endémica. En este territorio se han observado los 24 genotipos distintos descritos del virus de la PPA hasta la fecha, encontrándose la mayor variabilidad en el este del continente.
En el sudeste africano destaca un ciclo epidemiológico muy complejo caracterizado por la coexistencia de suidos silvestres, como el potamóquero de río (Potamochoerus larvatus), el facóquero común (Phacochoerus africanus) y el hilóquero (Hylochoerus meinertzhageni), garrapatas blandas del complejo O. moubata y cerdos domésticos. Los suidos silvestres del sudeste africano tienen la particularidad de ser tolerantes al desarrollo de la enfermedad, actuando como reservorios y una fuente permanente del virus. Además, el virus de la PPA es capaz de replicarse en las garrapatas del complejo O. moubata, las cuales pueden actuar como vectores en la transmisión del virus entre los suidos silvestres y los cerdos domésticos. La participación de los hospedadores silvestres, tanto suidos como garrapatas, hace extremadamente difícil su erradicación.
La situación es distinta en el oeste africano, donde los hospedadores silvestres no están presentes, siendo el cerdo doméstico el único hospedador involucrado. De tal forma que el control y la erradicación en el oeste de África pueden parecer más sencillo, sin embargo, también representa un gran reto sanitario. Esto es debido a que el sector porcino se ve afectado por factores socio-económicos que limitan la capacidad de los productores para implementar las medidas de control necesarias para una mejor gestión de esta enfermedad.
Peste Porcina Africana en Europa
En Europa, desde su re-introducción en 2007 a través de Georgia, la PPA ha ido avanzando sin control. En un primer lugar, la enfermedad comenzó su expansión hacia el norte, afectando en ese mismo año a Armenia, Azerbaiyán y la Federación Rusa. Desde la Federación Rusa, la PPA ha alcanzado países como Ucrania (2012) y Bielorrusia (2013). Posteriormente, en 2014 se produjo la entrada de la enfermedad en la Unión Europea (UE), concretamente en Lituania, Polonia, Letonia y Estonia. A partir de 2016, otros nueve países de Europa se han visto afectados como Moldavia (2016), Rumanía (2017), República Checa (2017), Bulgaria (2018), Hungría (2018), Bélgica (2018), Eslovaquia (2019), Serbia (2019) y recientemente Grecia (2020) (Figura 3). Esta situación es de elevadísimo riesgo para países vecinos como Francia, Alemania y España, siendo estos dos últimos los mayores productores de porcino de la Unión Europea, por lo que la notificación de esta enfermedad podría conllevar cuantiosas pérdidas económicas.
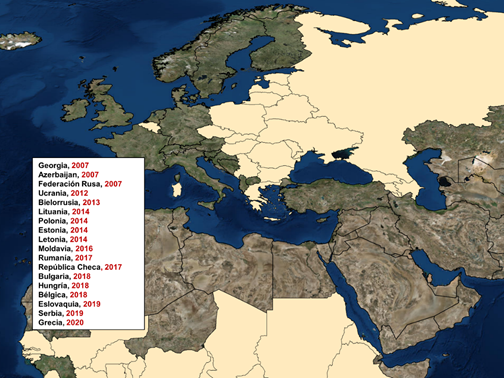
Figura 3. Epidemiología de la PPA en Europa desde 2007 hasta abril 2020.
En Europa se han visto afectados tanto cerdos domésticos como jabalíes, estos últimos han demostrado tener un papel muy importante en la persistencia y circulación del virus en este continente. A diferencia de los suidos silvestres de África, los jabalíes euroasiáticos son susceptibles al desarrollo de la enfermedad, cursando con un cuadro clínico muy similar al observado en cerdos domésticos. La elevada abundancia del jabalí en el territorio europeo condiciona aspectos muy importantes de la transmisibilidad de enfermedades infecciosas entre poblaciones.
Dentro del continente europeo se observan dos escenarios epidemiológicos diferentes en función del tipo de hospedador afectado predominante. Por un lado, se encuentran los países afectados de la Unión Europea (con la excepción de Rumanía, Bulgaria, Eslovaquia y Grecia), en donde más del 90% de los casos notificados se atribuyen a jabalíes, con brotes esporádicos en granjas de cerdos domésticos. Sin embargo, en el este de Europa, incluyendo países como Rusia, Ucrania, Bielorrusia, Moldavia y Rumanía, la PPA afecta mayoritariamente a granjas de cerdo doméstico y en menor medida a jabalíes. Esta diferencia puede ser explicada por el hecho de que estos últimos países presentan mayor número de granjas familiares o de traspatio. Este tipo de sistema de producción posee bajos niveles de bioseguridad y suelen estar ubicadas en áreas donde habitan jabalíes, lo que incrementa el riesgo de transmisión del virus a cerdos domésticos. Además, es posible que en este tipo de granjas se practique la alimentación de los cerdos con desperdicios alimenticios. Esta actividad ha sido históricamente una de las principales vías de transmisión del virus de PPA y está actualmente prohibida en la Unión Europea.
La isla de Cerdeña, en donde la PPA ha estado endémica desde 1978, en los últimos años ha logrado un descenso considerable en las notificaciones de la enfermedad, tanto en cerdo doméstico como en jabalí, hasta el punto de estar a las puertas de declarase libres de PPA. Esto ha sido posible tras enormes esfuerzos de estudios epidemiológicos, de la administración y el sector ganadero, siendo la captura y retirada de los cerdos criados en libertad una de las medidas más efectivas.
Peste Porcina Africana en Asia
El virus de la PPA se abre paso por primera vez en Asia en agosto de 2018, a través vez de China, en una granja de cerdos domésticos localizada en la ciudad de Shenyang. Las posibles fuentes de introducción, en base a las encuestas epidemiológicas, fueron la importación de lechones procedentes de áreas infectadas y la alimentación de animales con restos alimenticios contaminados. Los estudios genéticos del aislado mostraron similitud con los circulantes en Europa.
El avance de la PPA por todo el territorio chino ha sido considerablemente rápido en comparación con otros escenarios epidemiológicos. Esta rápida difusión también se ha visto reflejada en el avance transfronterizo, afectando a otros 11 países asiáticos en 2019 (Mongolia, Vietnam, Camboya, Hong Kong, Corea del Norte, Laos, Myanmar, Filipinas, Corea del Sur, Timor-Leste e Indonesia) (Figura 4). Recientemente, en marzo de 2020, Papúa Nueva Guinea ha confirmado la presencia de PPA en su territorio, lo que aumenta la preocupación en Australia debido a los pocos cientos de kilómetros que separan sus costas.
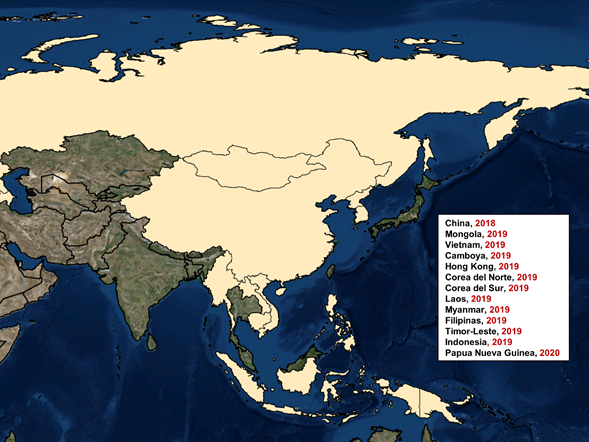
Figura 4. Epidemiologíade la PPA en Asia desde 2018
Algunos de los factores que están favoreciendo la dispersión de la enfermedad en este continente es i) la falta de experiencia en la detección, manejo y control de la PPA; ii) las características del sector porcino, ya que existe una elevada proporción de granjas de traspatio; y iii) la realización de prácticas de riesgo tradicionales, como el empleo de restos alimenticios o incluso el uso de sangre o derivados hemáticos como suplemento alimenticio. A excepción de Corea del Sur, donde se han reportado numerosos casos en jabalí, la mayoría de los casos notificados en los países asiáticos han sido reportados en cerdos domésticos.
A pesar de las medidas de control y prevención tomadas hasta ahora, la PPA ha seguido avanzando por este continente y causando la muerte de, al menos, 6 millones de animales. China es el mayor productor porcino mundial, con más de 400 millones de cerdos, por lo que esta situación es realmente alarmante, ya que está dando lugar a graves problemas económicos así como de abastecimiento, e incluso afectando al comercio internacional por el incremento del precio de la carne de cerdo.
Nuevos retos de investigación en Peste Porcina Africana
En vista de la situación actual, es necesario replantear y mejorar los planes y programas de control y prevención frente a la PPA. Entre los grandes retos del control de la PPA destaca la falta de tratamiento o vacuna disponible, así como la existencia de distintos escenarios epidemiológicos.
Por este motivo, gran parte de los estudios de investigación en PPA se están centrando en el desarrollo de una vacuna segura y eficaz. El desarrollo de una vacuna frente a la PPA se ha visto dificultado a lo largo de la historia por la gran complejidad del virus, la falta de conocimiento de los procesos relacionados con la interacción virus-hospedador, la ausencia de una respuesta inmunitaria neutralizante y ciertas dificultades técnicas como la adaptación del virus a una línea celular estable. Actualmente, nuestro grupo SUAT-UCM (www.sanidadanimal.info) está coordinando el proyecto VACDIVA (www.vacdiva.eu) (nº 862874, H2020), dotado con 10 millones de euros, con el fin de ampliar el conocimiento en esta área y poder conseguir una vacuna DIVA segura y eficaz, tanto para cerdo doméstico como para jabalíes.
Por otro lado, es importante que se continúen los estudios epidemiológicos encaminados a identificar los factores de riesgo en las regiones afectadas, así como las potenciales vías de introducción en los países libres. Es necesario adaptar los programas de control y erradicación a cada uno de los escenarios epidemiológicos, incorporando sus características culturales y sociológicas, así como reforzar las medidas de prevención en escenarios libres. La formación de veterinarios y ganaderos sobre la PPA es fundamental para evitar una mayor difusión de la enfermedad.
De esta forma, una vacuna eficaz y segura junto con el establecimiento de buenos planes de control y erradicación personalizados para cada uno de los escenarios epidemiológicos podría ser la solución para frenar la continua diseminación de la PPA.
Protocolos
- Procedmiento de la técnica de ELISA, mediante kit comercial para el diagnóstico de la PPA
- Procedimiento de la técnica de ELISA (OIE) para el diagnóstico serológico de la PPA
- Detección del VPPA mediante reacción en cadena de la polimerasa (PCR) convencional
- Detección del VPPA mediante reacción en cadena de la polimerasa (PCR) en tiempo real
- Genotipado del virus de la PPA mediante PCR convencional
- Prueba rápida (pen side) para la detección de anticuerpos de la PPA
- Detección del VPPA mediante PCR en tiempo real utilizando una sonda universal (Universal Probe Library, UPL)
Vídeos
Formas clínicas de PPA
Protege tu granja contra la PPA
PPA La enfermedad
Tesis Doctorales
- Avances en la monitorización y el control de la Peste Porcina Africana en la interfaz jabalí-cerdo doméstico
Estefanía Cadenas Fernández
Universidad Complutense de Madrid (realización en curso)
- Nuevas estrategias para el control y erradicación de la peste porcina africana
Cristina Jurado Díaz
Centro de Vigilancia Sanitaria Veterinaria (VISAVET). Universidad Complutense de Madrid, Noviembre de 2019
Sobresaliente Cum Laude por Unanimidad (Mención Internacional)
- Nuevas estrategias para la prevención y control de la peste porcina africana
Lina Mur Gil
Facultad de Veterinaria de la Universidad Complutense de Madrid, Octubre 2014
Sobresaliente Cum Laude por Unanimidad (Mención Europea)
- Nuevas aportaciones al diagnóstico serológico y molecular de la peste porcina africana
Carmina Gallardo
Facultad de Ciencias de la Universidad Autónoma de Madrid, Junio 2003
Sobresaliente Cum Laude
- Nuevas aportaciones al estudio de la patogenia de la peste porcina africana
Julia Martín Fernández
Facultad de Veterinaria de la Universidad Complutense de Madrid, 1992
Apto Cum Laude
- Evolución de la respuesta humoral en animales infectados con el virus de la peste porcina africana
Olga Hortigüela Martos
Facultad de Biológicas de la Universidad Complutense de Madrid, 1990
Apto Cum Laude
- Nuevas aportaciones en el estudio de la respuesta humoral frente al virus de la peste porcina africana
María Luisa Arias Neira
Facultad de Ciencias de la Universidad Autónoma de Madrid, 1989
Apto Cum Laude
- Inmunoregulación del virus de la peste porcina africana
Silvia González Rebollar
Facultad de Veterinaria de la Universidad Complutense de Madrid, 1989
Apto Cum Laude
- Estudio inmunohistológico de los órganos linfoides mediante anticuerpos monoclonales en la peste porcina africana
Isabel Mínguez Tudela
Facultad de Veterinaria de la Universidad Complutense de Madrid, 1987
Apto Cum Laude
Publicaciones indexadas
- Ito S., Bosch J., Jurado C., Sanchez-Vizcaino JM., Isoda N. "Risk Assessment of African Swine Fever Virus Exposure to Sus scrofa in Japan Via Pork Products Brought in Air Passengers` Luggage". Pathogens, 9(4):302. 04/2020. (A)
- Cadenas-Fernández E., Sanchez-Vizcaino JM., Kosowska A., Rivera B., Mayoral-Alegre F., Rodriguez-Bertos A., Yao J., Bray J., Lokhandwala S., Mwangi W., Barasona JA. "Adenovirus-vectored African Swine Fever Virus Antigens Cocktail Is Not Protective against Virulent Arm07 Isolate in Eurasian Wild Boar". Pathogens, 9(171):1-14. 02/2020. (A)
- Cadenas-Fernández E., Sanchez-Vizcaino JM., Pintore A., Denurra D., Cherchi M., Jurado C., Vicente J., Barasona JA. "Free-Ranging Pig and Wild Boar Interactions in an Endemic Area of African Swine Fever". Frontiers in veterinary science, 6:376. 10/2019. (A)
- Jurado C., Mur L., Perez-Aguirreburualde MS., Cadenas-Fernández E., Martinez-Lopez B., Sanchez-Vizcaino JM., Perez A. "Risk of African swine fever virus introduction into the United States through smuggling of pork in air passenger luggage". Scientific reports, 9(1):14423. 10/2019. (A)
- Barasona JA., Gallardo C., Cadenas-Fernández E., Jurado C., Rivera B., Rodriguez-Bertos A., Arias M., Sanchez-Vizcaino JM. "First Oral Vaccination of Eurasian Wild Boar Against African Swine Fever Virus Genotype II". Frontiers in veterinary science, 6(137):1-10. 04/2019. (A)
- Laddomada A., Rolesu S., Loi F., Cappai S., Oggiano A., Madrau MP., Sanna ML., Pilo G., Bandino E., Brundu D., Cherchi S., Masala S., Marongiu D., Bitti G., Desini P., Floris V., Mundula L., Carboni G., Pittau M., Feliziani F., Sanchez-Vizcaino JM., Jurado C., Guberti V., Chessa M., Muzzeddu M., Sardo D., Silvio B., Mulas D., Salis G., Zinzula P., Piredda S., De Martini A., Sgarangella F. "Surveillance and control of African Swine Fever in free-ranging pigs in Sardinia". Transboundary and Emerging Diseases, In Press, 66(3):1114-1119. 02/2019. (A)
- Cristina Jurado, Estefanía Cadenas Fernández, Sánchez-Vizcaíno JM. La peste porcina africana, la mayor amenaza del sector porcino mundial. Suis, ISSN 1699-7867, Nº. 156, 2019, págs. 12-18
- Arias M., Jurado C., Gallardo C., Fernandez-Pinero J., Sanchez-Vizcaino JM. "Gaps in African swine fever: Analysis and priorities". Transboundary and Emerging Diseases, 65 Suppl 1:235-247. 05/2018
- Jurado C., Martinez-Aviles M., De La Torre A., Stukelj M., de Carvalho Ferreira HC., Cerioli M., Sanchez-Vizcaino JM., Bellini S. "Relevant Measures to Prevent the Spread of African Swine Fever in the European Union Domestic Pig Sector". Front Vet Sci. 5:77. 4/2018.
- Jurado C., Fernández-Carrión E., Mur L., Rolesu S., Laddomada A., Sánchez-Vizcaíno JM. "Why is African swine fever still present in Sardinia?". Transbound Emerg Dis 65(2):557-566. 4/2018.
- Alkhamis MA., Gallardo C., Jurado C., Soler A., Arias M. y Sanchez-Vizcaino JM. "Phylodynamics and evolutionary epidemiology of African swine fever p72-CVR genes in Eurasia and Africa". PLoS ONE. 13(2):e0192565. 2/2018.
- Mur L., Sánchez-Vizcaíno J.M. Fernández-Carrión E., Jurado C., Rolesu s, Feliziani F., Laddomada A., Martínez-López B. "Understanding African Swine Fever infection dynamics in Sardinia using a spatially explicit transmission model in domestic pig farms". Transbound Emerg Dis. 65(1):e123-34. 2/2018.
- Arias M., Jurado C., Gallardo C., Fernandez-Pinero J., Sanchez-Vizcaino JM. "Gaps in African swine fever: Analysis and priorities". Transbound Emerg Dis. In press. 9/2017
- Bosch J., Rodriguez A., Iglesias I., Munoz MJ., Jurado C., Sanchez-Vizcaino JM. y de la Torre A. "Update on the Risk of Introduction of African Swine Fever by Wild Boar into Disease-Free European Union Countries". Transboundary and Emerging Diseases. 64(5):1424-1432. 10/2017
- Achenbach JE., Gallardo C., Nieto-Pelegrín E., Rivera-Arroyo B., Degefa-Negi T., Arias M., Jenberie S., Mulisa DD., Gizaw D., Gelaye E., Chibssa TR., Belaye A., Loitsch A., Forsa M., Yami M., Diallo A., Soler A., Lamien CE., Sánchez-Vizcaíno JM. "Identification of a New Genotype of African Swine Fever Virus in Domestic Pigs from Ethiopia". Transbound Emerg Dis. 64(5):1393-1404. 10/2017
- Fernandez-Carrion E, Martinez-Aviles M, Ivorra B, Martinez-Lopez B, Ramos AM, Sanchez-Vizcaino JM. "Motion-based video monitoring for early detection of livestock diseases: The case of African swine fever". PLoS One. 12(9):e0183793. 9/2017
- Mur L., Iscaro C., Cocco M., Jurado C., Rolesu S., De Mia GM., Feliziani F., Pérez-Sánchez R., Oleaga A., Sánchez-Vizcaíno JM. "Serological Surveillance and Direct Field Searching Reaffirm the Absence of Ornithodoros Erraticus Ticks Role in African Swine Fever Cycle in Sardinia". Transbound Emerg Dis. 64(4):1322-1328. 8/2017.
- Guinat C., Vergne T., Jurado-Diaz C., Sánchez-Vizcaíno JM., Dixon L., Pfeiffer DU. "Effectiveness and practicality of control strategies for African swine fever: what do we really know?". Vet Rec. 180(4):97. 1/2017.
- Mur L., Igolkin A., Varentsova A., Pershin A., Remyga S., Shevchenko I., Zhukov I., Sánchez-Vizcaíno, JM., “Detection of African Swine Fever Antibodies in Experimental and Field Samples from the Russian Federation: Implications for Control”. Transboundary and Emerging Diseases. 63(5):e436-40.10/2016.
- Giménez-Lirola LG., Mur L., Rivera B., Mogler M., Sun Y., Lizano S., Goodell C., Harris DL., Rowland RR., Gallardo C., Sánchez-Vizcaíno JM., Zimmerman J. "Detection of African Swine Fever Virus Antibodies in Serum and Oral Fluid Specimens Using a Recombinant Protein 30 (p30) Dual Matrix Indirect ELISA". PLoS One. 9;11(9):e0161230. 9/2016.
- Mur L., Atzeni M., Martínez-López B., Feliziani F., Rolesu S., Sanchez-Vizcaino JM. "Thirty-Five-Year Presence of African Swine Fever in Sardinia: History, Evolution and Risk Factors for Disease Maintenance". Transbound Emerg Dis. 63(2):e165-77. 4/2016.
- Pietschmann J., Mur L., Blome S., Beer M., Perez-Sanchez R., Oleaga A., Sanchez-Vizcaino JM. "African swine fever virus transmission cycles in Central Europe: Evaluation of wild boar-soft tick contacts through detection of antibodies against Ornithodoros erraticus saliva antigen". BMC Veterinary Research. 12(1):1. 1/2016
- De la Torre A, Bosch J, Iglesias I, Muñoz MJ, Mur L, Martínez-López B, Martínez M, Sánchez-Vizcaíno JM. "Assessing the Risk of African Swine Fever Introduction into the European Union by Wild Boar". Transbound Emerg Dis. 62(3):272-9. 6/2015.
- Sanchez-Vizcaino JM., Mur L., Bastos ADS., Penrith ML. "New insights into the role of ticks in African swine fever epidemiology". Rev Sci Tech Off Int Epiz. 34(2):503-511. 11/2015
- Nieto-Pelegrin E., Rivera B., Sanchez-Vizcaino JM. "First Detection of Antibodies Against African Swine Fever Virus in Faeces Samples". Transbound Emerg Dis. 62(6):594-602. 12/2015
- Gallardo C., Soler A., Nieto R., Sanchez MA., Martins C., Pelayo V., Carrascosa AL., Revilla Y., Simon A., Briones V., Sanchez-Vizcaino JM., Arias M. "Experimental Transmission of African Swine Fever (ASF) Low Virulent Isolate NH/P68 by Surviving Pigs". Transbound Emerg Dis. 62(6):612-622. 12/2015
- Martinez-López, B., M. Perez, A., Feliziani, F., Rolesu, S., Mur, L., Sánchez-Vizcaíno, JM., “Evaluation of the risk factors contributing to the African swine fever occurrence in Sardinia, Italy” frontiers in Microbiology, 314(6):1-10. 4/2015.
- Sanchez-Vizcaino JM., Mur L., Gomez-Villamandos JC., Carrasco L. "An Update on the Epidemiology and Pathology of African Swine Fever". Journal of Comparative Pathology. 152(1):9-21. 1/2015.
- Mur L., Martínez-López B., Costard S., de la Torre A., Jones BA., Martínez M., Sánchez-Vizcaíno F., Muñoz MJ., Pfeiffer DU., Sánchez-Vizcaíno, JM., Wieland B. "Modular framework to assess the risk of African swine fever virus entry into the European Union". BMC Vet Res. 10(1):145. 7/2014
- N. LeBlanc, M. Cortey, J. Fernandez Pinero, C. Gallando, Mesembe, A. R Okurut, L. Hearh, J.van Heerden, J.M. Sánchez-Vizcaíno, K. Stahl and S. Belák. ”Development of a Suspension Microarray for the Genotyping of African Swine Fever Virus Targeting the SNPs in the C-Terminal End of the p72 Gene Region of the Genome”. Transboundary and Emerging Diseases. 60(4):378-383. 8/2013.
- .Costard, S., Anne Jones, B., Martínez-López, B., Mur L., de la Torre, A., Martínez, M., Sánchez-Vizcaíno, F., Sánchez-Vizcaíno, J.M., Udo Pfeiffer, D., Wieland, B.,(2013) “Introduction of African Swine Fever into the European Union through ilegal Importation of Pork and Pork Products”. PLoS ONE 8(4): e61104. 4/2013.
- Mur, L., Gallardo, C., Soler, A., Zimmermman, J., Pelayo, V., Nieto, R., Sanchez-Vizcaino, JM., Arias, M. (2013) "Potential use of oral fluid samples for serological diagnosis of African swine fever". Veterinary Microbiology. 165(1-2):135-9. 7/2013.
- Costard, S., Mur, L., Lubroth, J., Sanchez-Vizcaino, JM., Pfeiffer, DU. (2013) "Epidemiology of African Swine Fever Virus". Virus Res. 173(1):191-7. 4/2013
- Sánchez-Vizcaíno, J.M., Mur L., Martínez-López B., (2013) “African swine fever (ASF): Five years around Europe”. Veterinary Microbiology 26;165(1-2):45-50. 7/2013.
- Mur, L., Martínez-López, B., Gallardo, C., Gortazar, C. Sánchez-Vizcaíno, JM. (2012) "Monitoring of African Swine Fever in the Wild Boar Population of the Most Recent Endemic Area of Spain". Transboundary and Emerging Diseases. 59(6):526-31. 12/2012.
- Sánchez-Vizcaíno, JM., Mur, L., and Martínez-López, B. (2012) "African Swine Fever: An Epidemiological Update". Transboundary and Emerging Diseases. Volume 59, Issue Supplement s1: 27-35. 3/2012.
- Mur, L., Martínez-López, B., Sánchez-Vizcaíno, JM. (2012) "Risk of African swine fever introduction into the European Union through transport-associated routes: returning trucks and waste from international ships and planes". BMC Vet Res. 8:149. 8/2012.
- Mur, L., Martinez-Lopez, B., Martinez, M., Costard, S., Wieland, B., Pfeiffer, DU. Sanchez-Vizcaino, JM. (2012). "Quantitative Risk Assessment for the Introduction of African Swine Fever Virus into the European Union by Legal Import of Live Pigs". Transboundary and emerging diseases. 59(2):134-44.4/2012.
- Gallardo, C.; Blanco, E.; Rodríguez, MJ.; Carrascosa, A.; Sanchez-Vizcaino. JM. (2006). Antigenic properties and diagnostic potential of African swine fever virus protein pp62 expressed in insect cells. J. Clin Microb 44, (3) 1489-1495
- Aguero, M.; Fernández, J.; Romero, L.; Sánchez, C.; Arias, M.; Sánchez-Vizcaíno, JM. (2003). Highly sensitive PCR assay for routine diagnosis of African swine fever virus in clinical samples. J. Clinical Microbiology 41 (9) 4431-4434.
- Blanco, E.; Rodríguez, J.; Carrascosa, A.; Sánchez-Vizcaíno, JM. (2000). Application of recombinant proteins p32, p54, pp62, and p10 to the development of improved methods for the diagnosis of African swine fever disease. Journal of Clinical Virology, 18: 159.
- Rodríguez, F.; Martín de las Muelas, J.; Herraez, P.; Sánchez-Vizcaíno, JM.; Fernández, A. (1996). Immunohistopathological studies of African swine fever (Strain E-75) infected bone marrow. J. Comp. Path. 114, 399-406.
- Bech-Nielsen. S.; Fernández, J.; Martínez-Pereda, F.; Espinosa, J.; Pérez Bonilla, Q.; Sánchez-Vizcaíno, JM. (1995). A case study an Outbreak of African swine fever in Spain. Br. Vet. Journal. 151(2), 203-214.
- Mebus, C.A.; House, C.; Ruiz Gonzalvo, F.; Pineda, J.M.; Tapiador, J.; Pire, J.J.; Bergada, J.; Yedloutschnig, R.J.; Sahu, S.; Becerra, V. and Sánchez-Vizcaíno, J.M. (1993). Survival of Foot-and-mouth disease, African swine fever, and Hog cholera viruses in spanish serrano cured hams and Iberian cured hams, shoulders and loins. Food Microbiology 10, 133-143.
- Arias, M.; Escribano, J.M.; Sánchez-Vizcaíno, J.M. (1993). Persistence of African swine fever antibody reactivity on ELISA and immunoblotting assays. Veterinary Record 133, 189-190.
- Bech-Nielsen, S.; Pérez Bonilla, Q.; Sánchez-Vizcaíno, J.M., (1993). Benefit-cost analysis of the current African swine fever erradication program in Spain and of an accelerated program. Preventive Veterinary Medicine, 17, 235-249.
- Bech-Nielsen, S.; Arias, M.L.; Panadero, J.; Escribano, J.A.; Gomez-Tejedor, C.; Perez. Q.; Sánchez-Vizcaíno, J.M. (1993). Laboratory diagnosis and disease occurrence in the current African swine fever eradication program in Spain, 1981-1991. Preventive Veterinary Medicine, 17, 225-234.
- González-Juarrero, M.; Lunney, J.K.; Sánchez-Vizcaíno, J.M.; Mebus, C. (1992). Modulation of splenic macrophages, and swine leukocyte antigen (SLA) and viral antigen expression following african swine fever virus (ASFV) inoculation. Arch. Virol. 123, 145-156.
- Fernández, A.; Perez, J.; Carrasco, L., Sierra, M.A.; Sánchez-Vizcaíno, J.M.; Jover, A. (1992). Detection of African swine fever viral antigens in paraffinembedded tissues by use of immunohistologic methods and polyclonal antibodies. Am. J. Vet. Med. 53 (8), 1462-1467.
- Fernández, A.; Pérez, J.; Carrasco, L.; Bautista, M.J.; Sánchez-Vizcaíno, J.M.; Sierra, M.A. (1992). Distribution of ASFV antigens in pig tissues experimentally infected with two different spanish virus isolates. J. Vet. Med. 39, 393-402.
- Martín-Fernández, J.; Igual, A.; Rueda, A.; Sánchez-Vizcaíno, J.M.; Alonso-Martí, C. (1991). Glomerular pathology in surviviring pigs experimentall, infected with ASF virus. Histol. Histopath 6, 115-121.
- González, S.; Mendoza, C.; Sánchez-Vizcaíno, J.M.; Alonso, F. (1990). Inhibitory effect of African swine fever virus on lectin-dependent swine lymphocyte proliferation. Veterinary Immunology and immunopathology, 26. 71-80.
- Pastor, M.J.; Laviada, M.D.; Sánchez‑Vizcaíno, J.M.; Escribano, J.M. (1989). Detection of African swine fever antibodies by immunoblotting assay. Can. J. Vet. Res. 53: 105‑107.
- Sierra, M.A.; Quezada, M.; Fernández, A.; Carrasco, L.; Gómez‑Villamandos, J.; Martín, J.; Sánchez‑Vizcaíno, J.M. (1989). Experimental African Swine Fever: Evidence of the virus in Intersticial Tissues of the Kidney. Vet. Pathol. 26: 173‑176.
- Mínguez, I.; Rueda, A.; Domínguez, J.; Sánchez‑Vizcaíno, J.M. (1988). Double labeling immunohistological study of african swine fever virus infected spleen and lymph nodes. Veterinary Pathology. 25: 193‑198.
- Wardley, R; Andrade, M; Black, D; Castro, F; Enjuanes, L; Hess, W; Mebus, C; Ordás, A; Rutilli, D; Sánchez‑Vizcaíno, J.M; Vigario, J; Wilkinson, P. (1983). African Swine Fever: Brief Review. Archives of Virology 76, 73‑90.
- Sánchez‑Vizcaíno, J.M; Slauson, D; Ruiz, F; Valero, F. (1981). Lymphocyte function and Cell Mediated Immunity in Pig infected with Experimental African Swine Fever. American Journal Veterinary Research 42 (8), 1335‑1341.
- Slauson, D; Sánchez‑Vizcaíno, J.M; (1981). Leukocyte ‑ dependent platelet vasoactive amine release and immune complex deposition in African Swine Fever. Veterinary Pathology 18, 813‑826.
Publicaciones de divulgación
- Jurado C., Cadenas-Fernández E., Sanchez-Vizcaino JM. "Peste porcina africana: situación actual y perspectivas de futuro". Sólo cerdo ibérico, 41, Aeceriber. 2019. (Outreach arcticle)
- Barasona JA., Gallardo C., Cadenas-Fernández E., Jurado C., Rivera B., Rodriguez-Bertos A., Arias M., Sanchez-Vizcaino JM. "Vacunación oral en jabalí. Una nueva esperanza frente a la peste porcina africana". Porcinews, 19:36-45, Grupo comunicación Agrinews, S.L. 2019. (Outreach arcticle)
- Arias M., de la Torre A., Dixon L., Gallardo C., Jori F., Laddomada A., Martins C., Parkhouse M., Revilla Y., Rodriguez F., Sanchez-Vizcaino JM. "Approaches and Perspectives for Development of African Swine Fever Virus Vaccines". Vaccines. 10/2017
- Giménez-Lirola, LG., Mur, L., Rivera, B., Lizano, S., Goodell, C., Rowland, R., Mogler, M., Harris, DL., Gallardo, C., Arias, M., Sánchez-Vizcaíno, JM., Zimmerman, J.(2014). “Simultaneous detection of African swine fever virus antibodies in serum and oral fluid using a recombinant p30 antibody ELISA”. 57th AAVLD/118th USAHA Meeting. Kansas City, Missouri,October 16-22
- Sánchez-Vizcaíno, JM., Mur, L., Sánchez-Matamoros, A., Martínez-López B. (2014). “Peste porcina Africana: Nuevos retos y medidas para evitar su propagación”. 82ª Sesión General. Asamblea Mundial. Organización mundial de sanidad animal. París 25-30 de mayo.
- Sánchez-Vizcaíno JM., Mur L., Sánchez-Matamoros A., Martínez-López B. (2014) "African Swine Fever: New challenges and measures to prevent its spread". 82nd General Session OIE. World Assembly. Paris. Mayo.
- Sánchez-Vzcaíno, J.M., Mur. L. (2012) “Peste porcína africana: un riesgo remergente procedente del Este de Europa”. Boletin OIE. Nª2012-4, pp.75-76.
- A.D. Zaberezhny. T.I Aliper, T.V Grebennikova, O.A. Verkhovsky, Sánchez-Vizcaíno JM, Mur, L., E.A. Nepoklonov, anda D.K. Lvov. (2012) “African Swine Fever in Russian Federation”. Problems of virology 5-2012, pp-4-10.
- Mur, L., Sánchez-Vizcaíno JM. (2012) "Peste porcina africana. Reconocer la enfermedad en campo". 3tres3.com. 30/3/2012
- Sánchez-Vizcaíno JM., Mur, L. (2012). "La PPA: Breve visión desde el pasado, presente y... futuro?". 3tres3.com. 2012/1/24.
- Mur, L., Martínez-López, B., Sánchez-Vizcaíno, JM (2011) “African swine fever: are we aware?” Pig progress. The international magazine on pig production. Vol.27. pp7-9.
- Mur, L., Martínez-López, B., Martínez-Avilés, M., Sánchez-Vizcaíno, JM. (2010). “African Swine Fever: Import of live pigs not a high risk”. Pig Progress, IPVS Focus, 20.
- Sánchez-Vizcaíno, JM. (2010). “La peste porcína africana”. Albéitar, 141, 22-24.
- Mur-Gil, L., Martínez-López, B., Sánchez-Vizcaíno, JM. (2009).” El despertar de la Peste Porcina Africana”. Revista Complutense de Ciencias Veterinarias. 3 (2) 149-157.
- Martínez-López, B., Perez, A., Sánchez-Vizcaíno, JM (2009). “Evaluation of the potential spread and effectiveness of control measures for Classical Swine Fever into Spain by using a spatial and stochastic model”. Proceeding, ISVEE XII.
- Hortiguela, O.; Sánchez-Vizcaíno, JM.; Arias, M. (1993). Quantification of the antibody response in african swine fever infection. Adaptation of an ELISA using monoclonal antibodies against different isotypes of immunoglobulins. Inv. Agr.: prod. Sanid anim. 8 (3), 289-298.
- Pastor, M.J.; Sánchez‑Vizcaíno, J.M.; Escribano, J.M. (1988). Dos nuevas técnicas para el diagnóstico de la peste porcina africana: Inmunoelectrotransferencia y enzimo‑inmuno‑adsorción. Med. Vet. 5, 275‑292.
- Sánchez-Vizcaíno, JM. (1984). Estudios de inmunidad de base celular e inmunopatología en la peste porcina africana. Ed. Universidad Complutense. M 4036-1984.
- Sánchez-Vizcaíno, J.M; Crowther, J; Wardley, R. (1983). A collaborative study on the use of the ELISA in the diagnosis of ASF. African Swine Fever. CEC. Eur. 8466, 297‑325.
- Sánchez-Vizcaíno, J.M; Tabares, E; Salvador, E; Ordás, A. (1982). Comparative Studies of two antigens for the use in the Indirect Elisa test for the detection of ASF antibodies. African Swine Fever. CEC Eur. 8466, 101‑106.
- Sánchez-Vizcaíno, J.M; Salvador, E; Mesanza, R; Sánchez Botija, C. (1980). Enzimoinmunoensayo (ELISA): Un nuevo método de diagnóstico para la peste porcina africana. ONE 9, 18‑23.
- Sánchez-Vizcaíno, J.M; Martín, L; Ordás, A. (1979). Adaptación y evaluación del enzimoinmunoensayo para la detección de anticuerpos de peste porcina africana. Laboratorio 67, (400) 311‑319.


